Explica cómo los electrones pueden
tener órbitas estables alrededor del núcleo y por qué los átomos presentaban
espectros de emisión característicos. Además el modelo de Bohr incorporaba
ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905. Bohr se basó en
el átomo de hidrógeno para hacer el modelo que lleva su nombre.
En este modelo
los electrones giran en órbitas circulares alrededor del núcleo, ocupando la
órbita de menor energía posible, o la órbita más cercana posible al núcleo. Cada órbita
puede entonces identificarse mediante un número entero n que toma valores desde
1 en adelante.
Bohr supuso
además que el momento angular de cada electrón estaba Cuantizado y sólo podía
variar en fracciones enteras de la constante de Planck. De acuerdo al número
cuántico principal calculó las distancias a las cuales se hallaba del núcleo
cada una de las órbitas permitidas en el átomo de hidrógeno.
POSTULADOS DE BOHR:
PRIMER
POSTULADO: Los electrones
describen órbitas circulares en torno al núcleo del átomo sin radiar energía,
ya que una carga con un movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la
órbita circular, las dos fuerzas que siente el electrón: fuerza columbiana
(Atrae) y la fuerza centrifuga (Repele); estas deben tener la misma magnitud en
toda la orbita.
SEGUNDO
POSTULADO: No toda órbita
para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio
cumpla que el momento angular, L, del electrón sea un múltiplo entero de
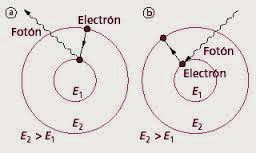
TERCER
POSTULADO: El electrón solo
emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho
cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre
ambos niveles. Este fotón, según la ley de Planck tiene una energía:

No hay comentarios:
Publicar un comentario